2014년09월03일 1번
[과목 구분 없음] 다음은 A가 분해되어 B가 생성되는 화학 반응식과 300K에서의 평형 상수(K)이다.
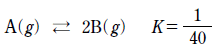
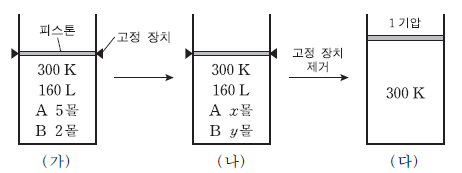
그림 (가)는 실린더에 A, B가 들어 있는 초기 상태를, (나)는 이 반응이 평형에 도달한 상태를, (다)는 고정 장치를 제거한 후 새로운 평형에 도달한 상태를 나타낸 것이다.
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 대기압은 1 기압, 기체 상수(R)는 0.08기압·L/몰·K이고, 피스톤의 질량과 마찰은 무시한다.) [3점]
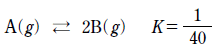
그림 (가)는 실린더에 A, B가 들어 있는 초기 상태를, (나)는 이 반응이 평형에 도달한 상태를, (다)는 고정 장치를 제거한 후 새로운 평형에 도달한 상태를 나타낸 것이다.

이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 대기압은 1 기압, 기체 상수(R)는 0.08기압·L/몰·K이고, 피스톤의 질량과 마찰은 무시한다.) [3점]

- ① ㄱ
- ② ㄴ
- ③ ㄱ, ㄷ
- ④ ㄴ, ㄷ
- ⑤ ㄱ, ㄴ, ㄷ
(정답률: 알수없음)
문제 해설
보기에서 정답이 "ㄱ, ㄷ" 인 이유는 다음과 같다.
ㄱ. 초기 상태에서는 A의 농도가 B의 농도보다 높기 때문에, 반응이 진행하여 B가 생성될 때 A의 농도가 감소하고 B의 농도가 증가한다. 이에 따라 평형 상수 K는 감소하게 된다.
ㄷ. 고정 장치를 제거하면서 실린더의 부피가 증가하면, A와 B의 농도가 모두 감소하게 된다. 그러나 A와 B의 농도 감소 비율은 K 값에 의해 결정되므로, K 값이 작아졌을 때보다 더 작아지지는 않는다. 따라서 평형 상태에서도 A와 B의 농도 비율은 초기 상태와 동일하게 유지된다.
ㄱ. 초기 상태에서는 A의 농도가 B의 농도보다 높기 때문에, 반응이 진행하여 B가 생성될 때 A의 농도가 감소하고 B의 농도가 증가한다. 이에 따라 평형 상수 K는 감소하게 된다.
ㄷ. 고정 장치를 제거하면서 실린더의 부피가 증가하면, A와 B의 농도가 모두 감소하게 된다. 그러나 A와 B의 농도 감소 비율은 K 값에 의해 결정되므로, K 값이 작아졌을 때보다 더 작아지지는 않는다. 따라서 평형 상태에서도 A와 B의 농도 비율은 초기 상태와 동일하게 유지된다.
이전 문제
다음 문제
연도별
- 2016년11월17일
- 2016년10월11일
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년04월18일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일

