2005년03월06일 34번
[열역학] 그림과 같이 부피가 일정하고 완전 단열된 통기 속에 A, B 기체가 칸막이로 격리되어 있다. 초기상태는 VA = VB = 0.14 m3, PA = 17atm, PB = 10.2atm, tA = 338℃, tB = 282℃ 그리고 CVA = 0.335㎈/g.K, CVB = 0.157㎈/g.K이다. A속에 들어 있는 H2O의 량은?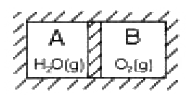

- ① 0.047 ㎏.mol
- ② 0.091 ㎏.mol
- ③ 0.136 ㎏.mol
- ④ 0.182 ㎏.mol
(정답률: 27%)
문제 해설




연도별
- 2022년04월24일
- 2022년03월05일
- 2021년09월12일
- 2021년05월15일
- 2021년03월07일
- 2020년09월26일
- 2020년08월22일
- 2020년06월06일
- 2019년09월21일
- 2019년04월27일
- 2019년03월03일
- 2018년09월15일
- 2018년04월28일
- 2018년03월04일
- 2017년09월23일
- 2017년05월07일
- 2017년03월05일
- 2016년10월01일
- 2016년05월08일
- 2016년03월06일
- 2015년09월19일
- 2015년05월31일
- 2015년03월08일
- 2014년09월20일
- 2014년05월25일
- 2014년03월02일
- 2013년09월28일
- 2013년06월02일
- 2013년03월10일
- 2012년09월15일
- 2012년05월20일
- 2012년03월04일
- 2011년10월02일
- 2011년06월12일
- 2011년03월20일
- 2010년09월05일
- 2010년05월09일
- 2010년03월07일
- 2009년08월30일
- 2009년03월01일
- 2008년09월07일
- 2007년05월13일
- 2007년03월04일
- 2006년05월14일
- 2006년03월05일
- 2005년05월29일
- 2005년03월20일
- 2005년03월06일
- 2004년09월05일
- 2004년05월23일
- 2004년03월07일
- 2003년08월31일
- 2003년05월25일
- 2003년03월16일
진행 상황
0 오답
0 정답
또한, A와 B의 부피 변화량은 같으므로, A와 B의 압력 변화량도 같다.
따라서, A와 B의 초기 압력 차이와 온도 차이가 줄어들면서, A와 B의 압력과 온도는 서로 같아질 것이다.
이때, A와 B의 최종 압력과 온도는 각각 13.6atm, 310K이다.
이 상태에서, A와 B 속의 H2O의 몰수는 각각 PV = nRT를 이용하여 계산할 수 있다.
A 속의 H2O의 몰수는 (17atm)(0.14m3) / (8.314 J/mol.K)(338+273K) = 0.012 mol이다.
B 속의 H2O의 몰수는 (10.2atm)(0.14m3) / (8.314 J/mol.K)(282+273K) = 0.007 mol이다.
따라서, 전체 시스템에 있는 H2O의 몰수는 0.012 mol + 0.007 mol = 0.019 mol이다.
또한, H2O의 분자량은 18 g/mol이므로, 전체 시스템에 있는 H2O의 질량은 0.019 mol x 18 g/mol = 0.342 g이다.
마지막으로, 전체 시스템의 부피는 0.28 m3이므로, 전체 시스템에 있는 H2O의 밀도는 0.342 g / 0.28 m3 = 1.221 g/m3이다.
따라서, 전체 시스템에 있는 H2O의 량은 0.047 kg.mol이다.
따라서, 정답은 "0.047 kg.mol"이다.